Spændingsrækken
Guld skinner og vil selv efter mange år være smukt og blankt, mens kæden på din cykel ruster lidt for hurtigt. Der er stor forskel på, hvor nemt de to metaller indgår i kemiske reaktioner. Spændingsrækken er en oversigt over de forskellige metallers evne til at indgå i en kemisk reaktion.
Fokusord
- en spændingsrække
- rust
- at oxidere
- ir
- et uædelt metal
- et ædelt metal
Jern og rust
Er kæden på din cykel rusten? Så er du ikke alene. En cykelkæde er lavet af jern, og jern ruster. Du kan smøre den med kædeolie for at holde den fri for rust, men det er svært at forhindre jern i at ruste. Når jern ruster, går det i forbindelse med luftens oxygen. Den rødlige rust er en kemisk forbindelse mellem jern og oxygen. I jernminer finder man heller ikke rent jern. Her henter man jernmalm, som er en slags rust. Malmen skal først igennem en længere proces, før vi har rent jern.
Kobber og guld
Jern er ikke det eneste metal, der reagerer med luftens oxygen. Det gør langt de fleste metaller. Man siger, at de oxiderer. Når kobber reagerer med luftens oxygen, danner det ikke rødlig rust, men grønlig ir. Fx er Frihedsgudindens grønne farve i virkeligheden kobber, der er irret.

© Getty Images.
Guld er et af de få metaller, der ikke oxiderer. Guld er derfor også et af de eneste metaller, man kan finde i ren form i miner. Den største guldklump i verden blev fundet i Brasilien i 1983 og indeholder 52 kg rent guld. Til sammenligning er der aldrig fundet en stor klump jern eller kobber. De findes som malm, der først skal igennem en oprensning, før man har frit jern eller kobber. Jern og kobber reagerer nemlig over tid med luftens oxygen.
Oxidere og reducere
Når et metal oxiderer, afgiver det elektroner. Så når jern eller kobber oxiderer, afgiver det altså elektroner til fx luftens oxygen. Oxygen modtager dermed elektroner. Man siger, at oxygen bliver reduceret. Når et grundstof bliver oxideret, er der altid et andet grundstof, der bliver reduceret.
Nogle metaller bliver let oxideret. Dem kalder man uædle. Andre metaller, som fx guld, bliver næsten aldrig oxideret. Dem kalder man ædle.
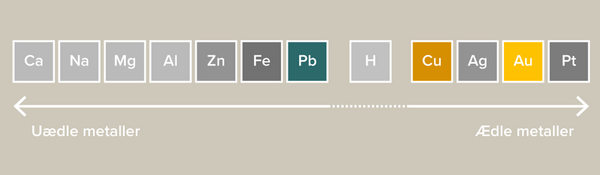
Hvad er spændingsrækken?
Man kan sammenligne de forskellige metaller ved at sætte dem i rækkefølge efter, hvor villige de er til at afgive deres elektroner. Det kalder man for spændingsrækken. Hvis et metal let afgiver elektroner, står det længst til venstre. Hvis det ikke afgiver elektroner så let, står det længst til højre.
Batterier
Hvis du kigger på spændingsrækken, kan du se, at zink (Zn) står til venstre for kobber (Cu). Det betyder, at zink er mere uædelt end kobber. Hvis du forbinder zink og kobber med ledninger, vil der løbe elektroner fra zink til kobber. Elektroner, der løber i en ledning, er det samme som elektrisk strøm. Et af verdens første batterier bestod netop af zink- og kobberplader forbundet med en ledning. Man bruger stadig metaller og spændingsrækken til at lave nutidige batterier. De fleste mobilbatterier indeholder lithium, som ligger helt til venstre i spændingsrækken. Faktisk er lithium så uædelt, at det slet ikke er med på illustrationen herover, der kun viser et udvalg af alle metaller.

Hvad med hydrogen?
Hydrogen er også en del af spændingsrækken, selv om hydrogen er en gas og ikke et metal. Hydrogen er til gengæld en vigtig del af alle syrer. De metaller, der står til venstre for hydrogen, bliver opløst i syre, mens metallerne til højre ikke bliver opløst. Metallerne bliver opløst, fordi H+-ionerne i syren optager elektroner fra metallet. Magnesiums reaktion med syre ser sådan her ud:
$$Mg \ + \ 2H^+ \rightarrow Mg^{++} \ + \ H_2 $$
Hvis du kommer magnesium i syre, vil du kunne se hydrogen boble op som gas fra reaktionen.
Zink beskytter jern
Jern ruster. Jern ruster ekstra hurtigt, hvis det er i kontakt med oxygen og saltvand. Det er et kæmpeproblem for skibe af jern. Selv om man maler skibene med en særlig maling, der skal beskytte jernet mod saltvand, ruster et skib meget let i saltvand. Derfor sætter man en zinkklods på skibets skrog. Zink står til venstre for jern i spændingsrækken. Det betyder, at zink afgiver elektroner til jern. Når jern ruster, er det fordi, det afgiver elektroner til oxygen i luften. Men jernet kan nu stjæle elektroner fra zinkklodsen i stedet for at ruste. Så "ruster" zinkklodsen i sted. På den måde kan man beskytte skibet, hvis man bare husker at skifte zinkklodsen ud en gang imellem.